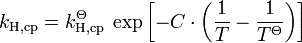What is Henry’s Law in Hindi | हेनरी का नियम क्या है | हेनरी का नियम के अनुप्रयोग
Henry’s Law of Partial Pressure and solubility of gas in a liquid (हेनरी का नियम क्या है?)
समाधान विलायक में विलेय का मिश्रण हैं। गैसें भी कई अलग-अलग घटनाओं का निर्माण करती हैं। हेनरी का कानून एक ऐसा कानून है जो पानी में गैस के विघटन को निर्देशित करता है। कानून सीमित दबाव मूल्य के तहत आदर्श स्थितियों तक सीमित है।
हेनरी का नियम क्या है? (What is Henry’s Law?)
हेनरी का कानून समाधान में गैस की आंशिक घुलनशीलता की रक्षा करने वाला कानून है। यह 1803 में विलियम हेनरी द्वारा तैयार किया गया था।
सामान्य तौर पर, यह अनुमान लगाया जा सकता है कि तरल में गैस की घुलनशीलता तरल की सतह के ऊपर मौजूद गैस के आंशिक दबाव के सीधे आनुपातिक होती है।
आंशिक दबाव स्थिरांक ‘K’ द्वारा दिया जाता है।
C= KPgas
C किसी विशेष विलायक (M या mL गैस / L की इकाइयों में) एक निश्चित तापमान पर गैस की घुलनशीलता है
k हेनरी का नियम स्थिर है (अक्सर M / atm की इकाइयों में)
Pgas गैस का आंशिक दबाव है (अक्सर एटीएम की इकाइयों में)
हेनरी का कानून एक आदर्श कानून है। यह केवल उस स्थिति में लागू होता है जब समाधान में अणु संतुलन में होते हैं।
समुद्र के अंदर जब दबाव बहुत अधिक है, तो हेनरी के कानून की प्रासंगिकता गायब हो गई है।
हेनरी की निरंतरता आयामहीन मात्रा है। यह तरल की सतह के ऊपर और पानी के अंदर गैस के आंशिक दबाव का अनुपात है। समाधान के अंदर गैस की घुलनशीलता का निर्धारण करते समय यह निरंतर अत्यंत महत्वपूर्ण हो जाता है।
| Forms of Henry’s law Constants | ||||
| equation: | ||||
| dimension: | 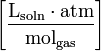 | 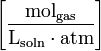 | 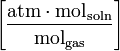 | dimensionless |
| O2 | 769.23 | 1.3 E-3 | 4.259 E4 | 3.180 E-2 |
| H2 | 1282.05 | 7.8 E-4 | 7.099 E4 | 1.907 E-2 |
| CO2 | 29.41 | 3.4 E-2 | 0.163 E4 | 0.8317 |
| N2 | 1639.34 | 6.1 E-4 | 9.077 E4 | 1.492 E-2 |
| He | 2702.7 | 3.7 E-4 | 14.97 E4 | 9.051 E-3 |
| Ne | 2222.22 | 4.5 E-4 | 12.30 E4 | 1.101 E-2 |
| Ar | 714.28 | 1.4 E-3 | 3.955 E4 | 3.425 E-2 |
| CO | 1052.63 | 9.5 E-4 | 5.828 E4 | 2.324 E-2 |
पेप्सी और कार्बोनेटेड पेय (Henry’s law in Carbonated Drinks )
पेप्सी या किसी अन्य कार्बोनेटेड पेय में बोतल के अंदर कार्बन डाइऑक्साइड सील होती है। यह वायुमंडलीय दबाव से थोड़ा ऊपर दबाव के साथ पैक किया जाता है। जब भी आप बोतल खोलते हैं तो कार्बन डाइऑक्साइड फ़िज़ होता है।
बोतल के बहुत ज्यादा हिलने से अणु जंगली तरीके से टकराते हैं। वे अधिक ऊर्जा के साथ बाहर आते हैं।
हेनरी के निरंतर और घुलनशीलता को प्रभावित करने वाले कारक
1. तापमान और दबाव (Temperature & Pressure)
2. विलायक की प्रकृति (Nature of the Solvent)
3. गैस की प्रकृति( Nature of the gas)
हेनरी कानून के अन्य अनुप्रयोग
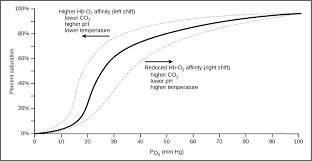
फेफड़ों में ऑक्सीजन युक्त हवा का वायुकोशीय आदान-प्रदान हेनरी लॉ का एक आदर्श उदाहरण है। आंशिक दबाव ऑक्सीजन युक्त और गैर ऑक्सीजन युक्त रक्त के बीच अंतर स्तंभ को निर्देशित करता है।
हेनरी के कानून पर तापमान निर्भरता (Henry’s law dependence on temperature)
Formula:
टी = किसी भी तापमान, केल्विन में
T = 298 K का मानक राज्य तापमान
kH, cp = दिए गए तापमान पर हेनरी के नियम की घुलनशीलता का रूप (तालिका 1 में दर्शाई गई इकाइयों में)
exp = घातीय कार्य
सी = केल्विन के आयाम के साथ एक स्थिर
तापमान में भिन्नता हेनरी के कानून में एक महत्वपूर्ण बदलाव का कारण बनती है।
बढ़ते तापमान के साथ, पानी में एक गैस की घुलनशीलता कम हो जाती है। उदाहरण के लिए तापमान में वृद्धि के साथ, जलीय वनस्पति और जीव मर चुके हैं। बढ़े हुए तापमान से जल शरीर में ऑक्सीजन की घुलनशीलता में हानि होती है।
विज्ञान के बारे में अधिक जानने के लिए hindi.todaysera.com/category/science/ से जुड़े रहें