मेंडलीफ की आवर्त सारणी | आधुनिक आवर्त सारणी हिंदी में | Periodic Table: Discovery, Concepts and arrangement of elements |आवर्त सारणी के तत्व
आवर्त सारणी (Periodic Table) रसायन विज्ञान के इतिहास में सबसे महत्वपूर्ण उपकरणों में से एक है। यह प्रत्येक ज्ञात रासायनिक तत्व के परमाणु गुणों का संक्षिप्त रूप में वर्णन करता है, जिसमें परमाणु संख्या, परमाणु द्रव्यमान और तत्वों के बीच संबंध शामिल हैं। समान रासायनिक गुणों वाले तत्वों को आवर्त सारणी में स्तंभों में व्यवस्थित किया जाता है।
आवर्त सारणी की खोज (Discovery of Periodic Table)
1. दिमित्री मेंडेलीव को आमतौर पर 1869 में आधुनिक आवर्त सारणी के आविष्कार का श्रेय जाता है, अलेक्जेंड्रे-एमिल बेगुएर डी चेंकोर्टिस ने पांच साल पहले परमाणु भार द्वारा तत्वों का आयोजन किया था।
2. जबकि मेंडेलीव और चेंकोर्टिस ने परमाणु भार द्वारा तत्वों की व्यवस्था की है, आधुनिक आवर्त सारणी को बढ़ती संख्या (19 वीं शताब्दी में अज्ञात एक अवधारणा) के अनुसार आदेश दिया गया है।
3. लोथर मेयर (1864) और जॉन न्यूलैंड्स (1865) दोनों ने प्रस्तावित तालिकाओं को आवधिक गुणों के अनुसार संगठित किया।
आधुनिक आवर्त सारणी से अंतर
डी चनकोर्टिस और मेंडेलीव ने परमाणु भार के आधार पर तत्वों का आयोजन किया। इससे समझ में आता है क्योंकि परमाणु की संरचना उस समय समझ में नहीं आई थी, इसलिए प्रोटॉन और आइसोटोप की अवधारणाओं का वर्णन किया जाना बाकी था।
आधुनिक आवर्त सारणी परमाणु भार बढ़ाने के बजाय परमाणु संख्या बढ़ाने के अनुसार तत्वों का आदेश देती है। अधिकांश भाग के लिए, यह तत्वों के क्रम को नहीं बदलता है, लेकिन यह पुराने और आधुनिक तालिकाओं के बीच एक महत्वपूर्ण अंतर है।
पहले की सारणी सही आवर्त सारणी थी क्योंकि उन्होंने अपने रासायनिक और भौतिक गुणों की आवधिकता के अनुसार तत्वों को समूहीकृत किया था।
आधुनिक आवधिक कानून (Modern Periodic law)
आधुनिक आवधिक कानून बताता है कि तत्वों के भौतिक और रासायनिक गुण उनके परमाणु संख्याओं के आवधिक कार्य हैं।
वैज्ञानिकों ने प्रत्येक पंक्ति में बाएं से दाएं अपने परमाणु संख्या के बढ़ते क्रम में तत्वों की व्यवस्था की। और पता चला कि समान गुणों वाले तत्व नियमित अंतराल के बाद दोहराते हैं।
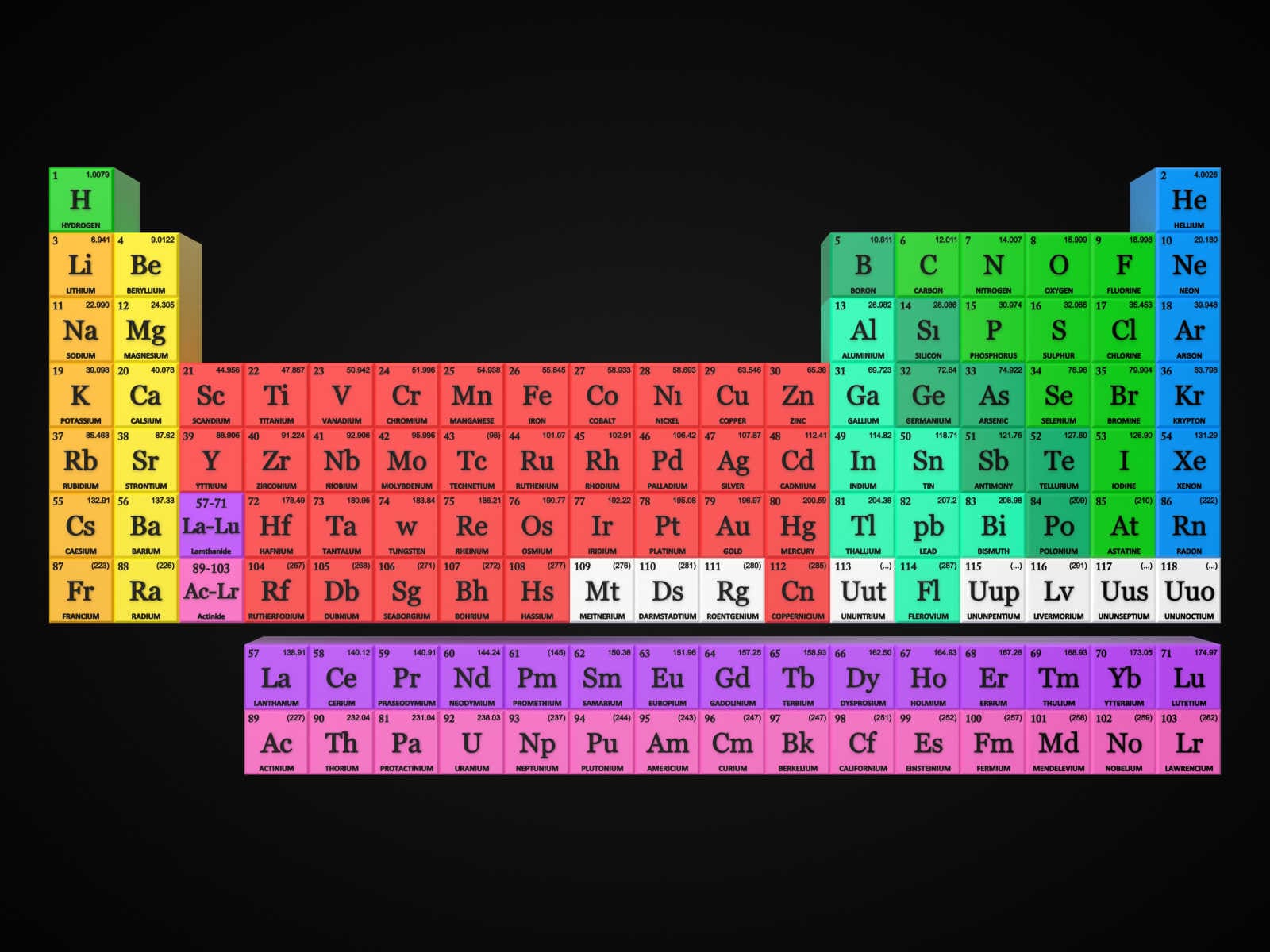
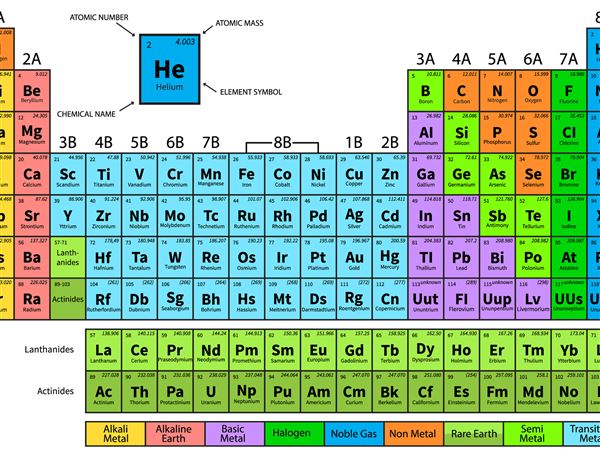
आवर्त सारणी को समझना (Reading of Periodic Table)
तालिका पढ़ना (Periodic Table Understanding)
आवर्त सारणी में महत्वपूर्ण जानकारी की एक विशाल मात्रा शामिल है:
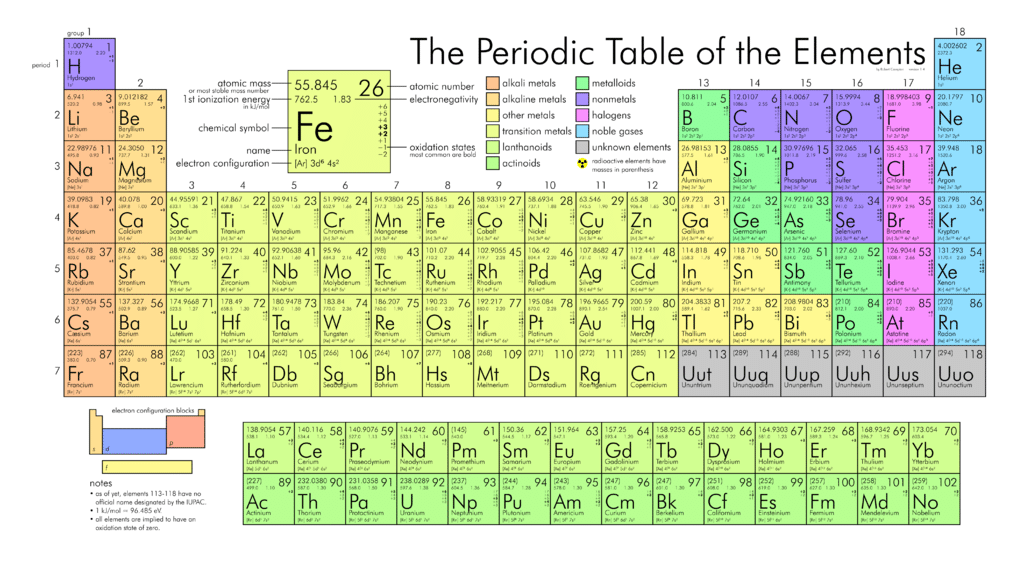
परमाणु क्रमांक:
किसी परमाणु में प्रोटॉनों की संख्या को उस तत्व की परमाणु संख्या के रूप में जाना जाता है। प्रोटॉन की संख्या निर्धारित करती है कि यह किस तत्व का है और तत्व के रासायनिक व्यवहार को भी निर्धारित करता है। उदाहरण के लिए, कार्बन परमाणुओं में छह प्रोटॉन होते हैं, हाइड्रोजन परमाणुओं में एक, और ऑक्सीजन परमाणुओं में आठ होते हैं।
परमाणु प्रतीक:
परमाणु प्रतीक (या तत्व प्रतीक) एक संक्षिप्त नाम है जो एक तत्व का प्रतिनिधित्व करता है (कार्बन के लिए “C”, हाइड्रोजन के लिए “H” और ऑक्सीजन के लिए “O”, आदि)। ये प्रतीक अंतरराष्ट्रीय स्तर पर उपयोग किए जाते हैं और कभी-कभी अप्रत्याशित होते हैं। उदाहरण के लिए, टंगस्टन के लिए प्रतीक “डब्ल्यू” है क्योंकि उस तत्व का एक अन्य नाम भेड़ियाग्राम है। इसके अलावा, सोने के लिए परमाणु प्रतीक यदि “एयू” है क्योंकि लैटिन में सोने के लिए शब्द अरुम है।
परमाण्विक भार:
किसी तत्व का मानक परमाणु भार, परमाणु द्रव्यमान इकाइयों (एमू) में तत्व का औसत द्रव्यमान होता है। व्यक्तिगत परमाणुओं में हमेशा परमाणु द्रव्यमान इकाइयों की पूर्णांक संख्या होती है; हालाँकि, आवर्त सारणी पर परमाणु द्रव्यमान को दशमलव संख्या के रूप में बताया गया है क्योंकि यह एक तत्व के विभिन्न समस्थानिकों का औसत है। एक तत्व के लिए न्यूट्रॉन की औसत संख्या को परमाणु द्रव्यमान से प्रोटॉन (परमाणु संख्या) की संख्या घटाकर पाया जा सकता है।
तत्वों के लिए परमाणु भार 93-118:
प्राकृतिक रूप से पाए जाने वाले तत्वों के लिए, उस तत्व के समस्थानिकों की प्राकृतिक बहुतायत के औसत से परमाणु भार की गणना की जाती है। हालांकि, लैब-निर्मित ट्रांस-यूरेनियम तत्वों के लिए – परमाणु संख्या वाले तत्व 92 से अधिक – कोई “प्राकृतिक” बहुतायत नहीं है। अधिवेशन तालिका में सबसे लंबे समय तक रहने वाले आइसोटोप के परमाणु भार को सूचीबद्ध करने के लिए है। इन परमाणु भारों को अनंतिम माना जाना चाहिए क्योंकि भविष्य में लंबे समय तक आधे जीवन के साथ एक नए आइसोटोप का उत्पादन किया जा सकता है।
इस श्रेणी के भीतर सुपरहीवी तत्व हैं, या 104 से ऊपर परमाणु संख्या वाले लोग हैं। परमाणु के नाभिक जितना बड़ा है – जो अंदर प्रोटॉन की संख्या के साथ बढ़ता है – वह तत्व जितना अधिक अस्थिर होता है। इस प्रकार, ये बाहरी तत्व क्षणभंगुर हैं, जो कि अंतरराष्ट्रीय तत्वों के शुद्ध और एप्लाइड रसायन विज्ञान (IUPAC) के अनुसार, हल्के तत्वों में क्षय होने से पहले स्थायी मिलिसेकंड हैं। उदाहरण के लिए, तालिका में सातवें पंक्ति, या अवधि को पूरा करते हुए दिसंबर 2015 में सुपरयूवी तत्वों को 113, 115, 117 और 118 को आईयूपीएसी द्वारा सत्यापित किया गया था। कई अलग-अलग प्रयोगशालाओं ने सुपरहीवी तत्वों का उत्पादन किया। परमाणु संख्या, अस्थायी नाम और आधिकारिक नाम हैं:
113: अंकुंटियम (UT), निहोनियम (Nh)
115: यूनुपेन्टियम (UUP), मोस्कोवियम (मैक)
117: अनयूसेप्टियम (UUas), टेननेसिन (Ts)
118: यूनोक्टियम (Uou), ओगेनेसन (Og)
आवर्त सारणी में अभी भी कई विसंगतियाँ हैं। जैसा कि नए तत्वों की खोज की जा रही है, आवधिक तालिका के मौजूदा रूप में लगातार संशोधन किए जा रहे हैं।
इलेक्ट्रॉन (Electrons)
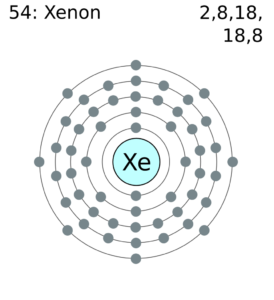
हम परमाणुओं के बारे में सोचते हैं कि प्याज की तरह थोड़ा सा बनाया गया है, जिसमें कोर, एल, एम, एन, ओ, पी, और क्यू नामक इलेक्ट्रॉनों की सात परतें हैं, जो कोर न्यूक्लियस के आसपास हैं।
परमाणु के बारे में सोचो एक केंद्रीय नाभिक जिसमें सभी प्रोटॉन और न्यूट्रॉन होते हैं, जो इलेक्ट्रॉनों वाले गोले की एक श्रृंखला से घिरे होते हैं।
आवधिक तालिका की प्रत्येक पंक्ति इलेक्ट्रॉनों के साथ इन गोले को भरने के लिए मेल खाती है। प्रत्येक शेल में उप-भाग होते हैं, और जिस क्रम में शेल / उप-भाग भरे जाते हैं वह आवश्यक ऊर्जा पर आधारित होता है, हालांकि यह एक जटिल प्रक्रिया है। हम बाद में इन पर वापस आएंगे।
सरल शब्दों में, प्रत्येक पंक्ति में पहला तत्व एक नए शेल को शुरू करता है जिसमें एक इलेक्ट्रॉन होता है, जबकि प्रत्येक पंक्ति में अंतिम तत्व में पूरी तरह से व्याप्त बाहरी शेल में उपधाराओं के दो (या पहली पंक्ति के लिए) होता है। इलेक्ट्रॉनों में ये अंतर तत्वों के बीच गुणों में कुछ समानताएं भी हैं।
इलेक्ट्रॉनों से भरी बाहरी परत में एक या दो उपधाराओं के साथ, प्रत्येक पंक्ति के अंतिम तत्व काफी अप्राप्य हैं, क्योंकि अन्य परमाणुओं के साथ बातचीत करने के लिए बाहरी शेल में कोई छेद या अंतराल नहीं हैं।
यही कारण है कि अंतिम कॉलम में तत्व, जैसे हीलियम हे, नियोन (Ne), आर्गन (Ar) और इसी तरह, नोबल गैसों (या अक्रिय गैसों) को कहा जाता है। वे सभी गैसें हैं और वे “महान” हैं क्योंकि वे शायद ही कभी अन्य तत्वों के साथ जुड़ते हैं।
इसके विपरीत, पहले स्तंभ के तत्व, हाइड्रोजन के अपवाद के साथ (अंग्रेजी व्याकरण की तरह, हमेशा एक अपवाद है!), क्षार धातु कहलाते हैं। पहले-स्तंभ तत्व धातु-जैसे वर्ण के होते हैं, लेकिन बाहरी आवरण में केवल एक इलेक्ट्रॉन के साथ, वे बहुत प्रतिक्रियाशील होते हैं क्योंकि यह अकेला इलेक्ट्रॉन रासायनिक संबंध में संलग्न करना बहुत आसान है। जब पानी में जोड़ा जाता है, तो वे जल्दी से क्षारीय (मूल) घोल बनाने के लिए प्रतिक्रिया करते हैं।
प्रत्येक खोल इलेक्ट्रॉनों की बढ़ती संख्या को समायोजित कर सकता है। पहला शेल (K) केवल दो फिट बैठता है, इसलिए आवर्त सारणी की पहली पंक्ति में केवल दो तत्व होते हैं: एक इलेक्ट्रॉन के साथ हाइड्रोजन (H) और दो के साथ हीलियम (He)।
दूसरा शेल (एल) आठ इलेक्ट्रॉनों को फिट करता है। इस प्रकार आवर्त सारणी की दूसरी पंक्ति में आठ तत्व होते हैं, जिसमें अतिरिक्त छह को समायोजित करने के लिए हाइड्रोजन और हीलियम के बीच का अंतर होता है।
तीसरा शेल (M) 18 इलेक्ट्रॉनों पर फिट बैठता है, लेकिन तीसरी पंक्ति में अभी भी केवल आठ तत्व हैं। ऐसा इसलिए है क्योंकि पहले दो इलेक्ट्रॉनों को चौथे शेल (एन) में जोड़े जाने के बाद (जब तक कि हम बाद में क्यों नहीं हो जाते) तक इस दस अतिरिक्त इलेक्ट्रॉनों को इस परत में जोड़ा नहीं जाता है।
तो अंतर को अतिरिक्त दस तत्वों को समायोजित करने के लिए चौथी पंक्ति में विस्तारित किया जाता है, जिससे तालिका के शीर्ष से “काटने” की ओर बढ़ जाता है। मध्य खंड में अतिरिक्त दस यौगिकों को संक्रमण धातु कहा जाता है।
चौथा खोल 32 इलेक्ट्रॉनों को रखता है, लेकिन फिर से अतिरिक्त इलेक्ट्रॉनों को इस शेल में नहीं जोड़ा जाता है जब तक कि कुछ को पांचवें (ओ) और छठे (पी) के गोले में भी नहीं जोड़ा गया है, जिसका अर्थ है कि चौथी और पांचवीं दोनों पंक्तियों में 18 तत्व हैं।
अगली दो पंक्तियों (छठी और सातवीं) के लिए, इन अतिरिक्त 14 तत्वों को शामिल करने के लिए तालिका बग़ल में और विस्तार करने के बजाय, जो इसे आसानी से पढ़ने के लिए बहुत चौड़ा कर देगा, उन्हें दो पंक्तियों के एक ब्लॉक के रूप में डाला गया है, जिसे लैंथेनॉइड्स कहा जाता है ( तत्व 57 से 71) और एक्टिनोइड्स (तत्व 89 से 103), मुख्य तालिका के नीचे।
आवर्त सारणी याद करने का आसान तरीका
Group – 1
Trick:- हलीना की रब से फ़रियाद।
| H | Li | Na | K | Rb | Cs | Fr |
| ह | ली | ना | की | रब | से | फरियाद |
Group – 2
Trick:- बेटा मांगे कार स्कूटर बाप राजी।
| Be | Mg | Ca | Sr | Ba | Ra |
| बेटा | मांगे | कार | स्कूटर | बाप | राजी |
D – Block Elements
Group – 3
Trick:- शक या लक।
| Sc | Y | La | Ac |
| शक | या | ल | अक |
Group – 4
Trick:- टीजर हफरफ।
| Ti | Zr | Hf | Rf |
| टी | जर | हफ | रफ |
Group – 5
Trick:- वन बटा डब।
| V | Nb | Ta | Db |
| व | नब | टा | डब |
Group – 6
Trick:- क्रमोव सग।
| Cr | Mo | W | Sg |
| क्र | मो | व | सग |
Group – 7
Trick:- मन टक रेभ।
| Mn | Tc | Re | Bh |
| मन | टक | रे | भ |
Group – 8
Trick:- फेरु ओस हस।
| Fe | Ru | Os | Hs |
| फे | रु | ओस | हस |
Group – 9
Trick:- कोरह इरमट।
| Co | Rh | Ir | Mt |
| को | रह | इर | मट |
Group – 10
Trick:- नी पड पट दस
| Ni | Pd | Pt | Ds |
| नी | पड | पट | दस |
Group – 11
Trick:- कु आग अउ राग।
| Cu | Ag | Au | Rg |
| कु | आग | अउ | राग |
Group – 12
Trick:- जन कड हज कन।
| Zn | Cd | Hg | Cn |
| जन | कड | हज | कन |
[Zinc, Cadmium, Mercury, Copernicium]
P – Block Elements
Group – 13
Trick:- बालग इनटल नह।
| B | Al | Ga | In | Tl | Nh |
| ब | अल | ग | इन | टल | नह |
Group – 14
Trick:- कसिजेसन पबफल।
| C | Si | Ge | Sn | Pb | Fl |
| क | सि | जे | सन | पब | फल |
Group – 15
Trick:- नपास्बी मक।
| N | P | As | Sb | Bi | Mc |
| न | प | अस | सब | बी | मक |
Group – 16
Trick:- ओस्सेटेपो लव।
| O | S | Se | Te | Po | Lv |
| ओ | स | से | टे | पो | लव |
Group – 17
Trick:- फकल ब्रिआट्स।
| F | Cl | Br | I | At | Ts |
| फ | कल | ब्र | इ | आट | टस |
Group – 18
Trick:- हे निआर कर जिरान ओग।
| He | Ne | Ar | Kr | Xe | Rn | Og |
| हे | नि | आर | कर | जि | रान | ओग |
F – Block Elements
* Lanthanide Series
Trick:- सिपर एन्ड पम सम युगड टब डाइहो इरटम यबलु।
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| सि | पर | एन्ड | पम | सम | यु | गड | टब | डाइ | हो | इर | टम | यब | लु |
**Actinide Series
Trick:- थपाउ नप्पु अमकम बककफ इसफमड नोलर।
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
| थ | पा | उ | नप | पु | अम | कम | बक | कफ | इस | फम | मड | नो | लर |
Original Source: https://hi-modernlekh.blogspot.com/2018/02/periodic-table-memorize-in-hindi.html)
Source: Lifehacker.com
Disclaimer: Information published here is based on different sources. Use your discretion while using any information for research,study or project.
अगर आपको हमारी यह पोस्ट ऐरोमैटिक यौगिक किसे कहते हैं, एरोमेटिक यौगिक की परिभाषा, Aromatic Compounds in Hindi Chemical Properties & Reactions पसंद आई है तो इस पोस्ट को फेसबुक, Instagram और Pintrest पे share करें।
रासायनिक विज्ञानं से जुड़ी और अधिक जानकारी के लिए hindi.todaysera.com/category/science/ से जुड़े रहें।