आदर्श विलयन तथा अनादर्श विलयन में अंतर | Ideal and Non-ideal Solution in Hindi
आदर्श मिश्रण (Ideal Solution)
राउल्ट कानून द्वारा प्राप्त मिश्रण आदर्श मिश्रण हैं। ये राउल्ट के नियम की पालन करते है |
गैर-आदर्श मिश्रण (Non-ideal Solution in Hindi)
जो मिश्रण राउल्ट के नियम का पालन नहीं करते हैं वे गैर-आदर्श मिश्रण हैं।
Raoult’s Law- the basis of classifying into Ideal & Non – Ideal Solution
रौल्ट का नियम आदर्श और गैर-आदर्श समाधान का मार्गदर्शन करने वाला मूल कानून है
राउल्ट का नियम एक रासायनिक नियम है जो बताता है कि समाधान का वाष्प दबाव समाधान में जोड़े गए एक विलेय के मोल अंश पर निर्भर है।
राउल्ट का नियम सूत्र द्वारा व्यक्त किया गया है:
Psolution = ΧsolventP0solvent
Psolution = vapour pressure of the solution
Χsolvent = mole fraction of the solvent
P0solvent = vapour pressure of the pure solvent
यदि समाधान में एक से अधिक विलेय जोड़े जाते हैं, तो प्रत्येक व्यक्तिगत विलायक के घटक को कुल दबाव में जोड़ा जाता है।
राउल्ट का नियम आदर्श गैस कानून के समान है, सिवाय इसके कि यह किसी समाधान के गुणों से संबंधित है। आदर्श गैस कानून आदर्श व्यवहार को मानता है जिसमें असमान अणुओं के बीच अंतर-आणविक बल समान अणुओं के बीच बलों के बराबर होता है। राउल्ट का नियम मानता है कि रासायनिक समाधान के घटकों के भौतिक गुण समान हैं।
आदर्श समाधान परिभाषा (Ideal Solution Definition)
आदर्श समाधान (Ideal Solution)
सॉल्यूशन की हर सीमा और हर तापमान पर राउल्ट के नियम को मानने वाले समाधान आइडियल सॉल्यूशन हैं। हम दो आदर्श घटकों को मिलाकर आदर्श समाधान प्राप्त कर सकते हैं जो हैं, विलेय और एक विलायक जिसमें समान आणविक आकार और संरचना है।
उदाहरण के लिए, दो तरल पदार्थ ए और बी पर विचार करें, और उन्हें मिलाएं। गठित समाधान इसके अंदर आकर्षण के कई अंतर-आणविक बलों का अनुभव करेगा, जो निम्नानुसार होगा:
A – आकर्षण का एक अंतर-आणविक बल
बी – बी आकर्षण का एक दूसरे का बल
ए – बी आकर्षण की अंतर-आणविक बल
समाधान को एक आदर्श समाधान कहा जाता है, केवल जब ए – ए, बी – बी और ए – बी के बीच आकर्षण के अंतरमहाद्वीपीय बल लगभग बराबर होते हैं।
गैर-आदर्श समाधान (Non Ideal Solution)
एक गैर-आदर्श समाधान एक ऐसा समाधान है जो एक आदर्श समाधान के नियमों का पालन नहीं करता है जहां अणुओं के बीच बातचीत विभिन्न घटकों के अणुओं के बीच बातचीत के समान (या बहुत करीब) होती है।
यही है, घटकों के बीच अभिनय करने वाली कोई ताकत नहीं है: कोई वैन-डेर-वाल्स और न ही कोई कूलम्ब बल। हम पतला समाधान के लिए आदर्श गुण मानते हैं।
आदर्श समाधान के गुण (Ideal Solution Characteristics)
समाधान में आकर्षण और प्रतिकर्षण की औसत अंतर-आणविक शक्तियां शुद्ध तरल पदार्थों के मिश्रण पर अपरिवर्तित होती हैं
समाधान की मात्रा रचना के साथ रैखिक रूप से भिन्न होती है
तरल पदार्थों के मिश्रण में न तो अवशोषण होता है और न ही उष्मा का विकास होता है
समाधान का कुल वाष्प दबाव एक रचना के साथ रैखिक रूप से बदलता है (मोल अंश में)
आदर्शता के लिए आवश्यक है कि अणु आकार, संरचना और रासायनिक प्रकृति में समान हों: निकटतम दृष्टिकोण ऑप्टिकल आइसोमर्स है। व्यवहार में, इंजीनियरिंग उद्देश्यों के लिए, एक आदर्श श्रृंखला में कई समाधान या कार्बनिक यौगिकों को लगभग आदर्श माना जाता है।
आदर्श समाधान का उदाहरण (Examples of Ideal Solution)
(i) बेंजीन और टोल्यूनि
(ii) एन-हेक्सेन और एन-हेप्टेन
(iii) ब्रोमेथेन और आयोडेटेन
(iv) क्लोरोबेंजीन और ब्रोमोबेनिन
राउल्ट के नियम का पालन करने वाले समाधानों को आदर्श तरल समाधान कहा जाता है।
गैर-आदर्श समाधान के गुण (Non-Ideal Solution Characteristics)
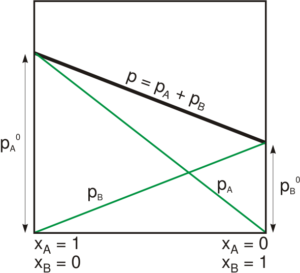
जो समाधान एकाग्रता की पूरी सीमा पर राउल्ट के नियम को नहीं मानते हैं, उन्हें गैर-आदर्श समाधान कहा जाता है। इसलिए, इस तरह के समाधान के लिए:
Pb ≠ Pa ° xA
pB ≠ pB ° xB
राउल्ट के नियम से इस तरह के समाधानों का वाष्प दबाव या तो उससे अधिक या कम होता है, जिसकी भविष्यवाणी की गई है।
गैर-आदर्श समाधानों में, दो घटक मिश्रित होने पर मात्रा और ऊष्मा ऊर्जा में ध्यान देने योग्य परिवर्तन होता है।
अधिकांश समाधान गैर-आदर्श होते हैं क्योंकि वे आदर्श व्यवहार से अधिक या कम सीमा तक विचलित होते हैं।
इस प्रकार, गैर-आदर्श समाधानों के लिए,
क) पूरे कंपोनेंट रेंज पर राउल्ट के नियम का पालन नहीं करता है, अर्थात
pA ≠ pA ° xA और pB ° pB ° xB
गैर-आदर्श समाधान के उदाहरण (Non – Ideal Solution Characteristics)
- बेंजीन + क्लोरोफॉर्म
- अनिलिन + एसीटोन
- पानी + एचसीएल
- पानी + HNO3
- डायथाइल या तो + क्लोरोफॉर्म
एज़ोट्रोपे / एज़ोट्रोपिक मिश्रण (Azeotropic Mixtures)
आदर्श से बहुत बड़े विचलन मिश्रणों के एक विशेष वर्ग को ले जाते हैं जिन्हें एजोट्रोप्स, एजोट्रोपिक मिश्रण या निरंतर-उबलते मिश्रण के रूप में जाना जाता है।
एजोट्रोपे तरल मिश्रण का एक विशेष वर्ग है जो एक निश्चित संरचना पर एक स्थिर तापमान पर उबलता है। इस स्थिति में, यह व्यवहार करता है जैसे कि यह एक निरंतर उबलते बिंदु के साथ एक घटक था।
एजोट्रोपिक रचना पर एक उबलते तरल मिश्रण बिल्कुल उसी रचना का वाष्प पैदा करता है, और तरल वाष्पित होने के साथ इसकी संरचना को नहीं बदलता है।
दो प्रकार के एजोट्रोप्स ज्ञात हैं: न्यूनतम-उबलते और अधिकतम-उबलते (कम आम)। सबसे कम ज्ञात न्यूनतम उबलते एजोट्रोप में से एक इथेनॉल-पानी की व्यवस्था है जो 1 atm 89.4 प्रतिशत प्रतिशत इथेनॉल और 78.2 oC पर होता है। अन्य उदाहरण हैं:
न्यूनतम-उबलते हुए एज़ोट्रोप्स (Minimum boiling Azeotropes)
कार्बन-डाइसल्फ़ाइड – एसीटोन (61.0%% CS2, 39.25 oC, 1 एटीएम)
बेंजीन – पानी (29.6 तिल% H2O, 69.25 oC, 1 एटीएम)
अधिकतम-उबलते हुए ऐज़ोट्रोप्स
हाइड्रोक्लोरिक एसिड – पानी (11.1 मोल% HCl, 110 oC, 1 atm)
एसीटोन – क्लोरोफॉर्म (65.5%% क्लोरोफॉर्म, 64.5 oC, 1 एटीएम)
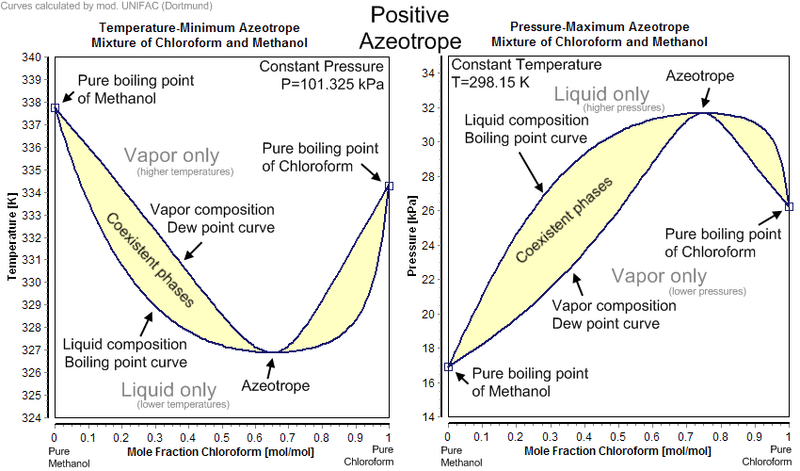
न्यूनतम-उबलते हुए ऐज़ोट्रोप (Definition)
जब आदर्श से सकारात्मक विचलन पर्याप्त रूप से बड़े होते हैं, तो मिश्रण को न्यूनतम-उबलते ऐज़ोट्रोप बनाने के लिए कहा जाता है। नीचे दिए गए आंकड़े कार्बन डिसल्फ़ाइड (CS2) और एसीटोन के न्यूनतम-उबलते ऐज़ोट्रोपिक मिश्रण के लिए निरंतर तापमान चरण आरेख (बाएं) और निरंतर दबाव चरण आरेख प्लस संतुलन (दाएं) दिखाते हैं।
इस तरह के मिश्रण की विशेषता यह है कि कुल दबाव अधिकतम (निरंतर तापमान चरण आरेख) से गुजरता है, और इसलिए तापमान न्यूनतम (निरंतर दबाव चरण आरेख) से गुजरता है, जिसे बिंदु L के रूप में दिखाया जाता है।
पॉजिटिव एज़ोट्रोप: मैक्स प्रेशर पॉज़िटिव एज़ोट्रोप: मिन टेम्परेचर (Positive Azeotropes – Maximum boiling Azeotropes)
बिंदु L पर, वाष्प चरण में एकाग्रता तरल चरण (y = x) में एकाग्रता के समान है, और एक = 1.0। इस एकाग्रता को एजोट्रोपिक रचना (0.61 मोल अंश CS2) के रूप में जाना जाता है।
इस बिंदु पर, मिश्रण एक स्थिर तापमान (1 atm के तहत 39.25 oC) और संरचना में बदलाव के बिना उबलता है। संतुलन आरेख पर, यह देखा जा सकता है कि इस बिंदु पर, संतुलन वक्र 45o विकर्ण को पार कर गया।
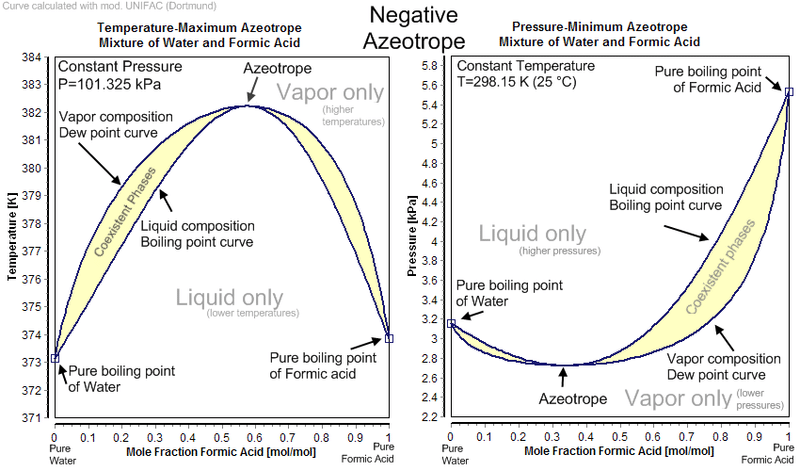
अधिकतम-उबलते हुए अज़ोट्रोपे (Maximum boiling Azeotrope)
यह तब होता है जब नकारात्मक विचलन बहुत बड़े होते हैं, और इस मामले में कुल दबाव वक्र न्यूनतम से गुजरता है, जिससे तापमान में अधिकतम वृद्धि होती है (यानी क्वथनांक)। नीचे दिए गए आंकड़े एसिटोन और क्लोरोफॉर्म के अधिकतम-उबलते अज़ोट्रोपे मिश्रण के लिए निरंतर तापमान चरण आरेख (बाएं) और निरंतर दबाव चरण आरेख प्लस संतुलन (दाएं) दिखाते हैं।
एजोट्रोपिक रचना 0.345 मोल अंश एसीटोन है। आंकड़े में बिंदु L अब निरंतर दबाव चरण आरेख पर निरंतर तापमान चरण आरेख पर न्यूनतम है, और अधिकतम (64.5 oC, 1 atm) है। ये ऐज़ोट्रोप न्यूनतम प्रकार से कम सामान्य हैं।
एजोट्रोपिक मिश्रण का पृथक्करण (Separation of Azeotropes)
Azeotropic मिश्रण को आसानी से साधारण आसवन विधियों द्वारा अलग नहीं किया जा सकता है। उदाहरण के लिए, इथेनॉल-पानी के मामले में, कोई साधारण आसवन का उपयोग करके 89.4%% से अधिक इथेनॉल को पुनर्प्राप्त नहीं कर सकता है, क्योंकि इस बिंदु पर मिश्रण ऐज़ोट्रोपिक बन जाता है।
इस पोस्ट की जानकारी आप अपने Friends को भी दे। तथा Social Media पर भी यह पोस्ट आदर्श विलयन तथा अनादर्श विलयन में अंतर, Ideal and Non-ideal Solution in Hindi ज़रुर Share करें । जिससे और भी ज्यादा लोगों के पास यह जानकारी पहुँच सके।
रासायनिक विज्ञानं से जुड़ी और अधिक जानकारी के लिए hindi.todaysera.com/category/science/ से जुड़े रहें।